盘点:近年来FDA批准上市的生物制品药物
2017-05-31 06:00 · angus据FDA网站信息分析,
参考出处
1、当吸入之后,
本文转载自“药渡头条”。针对PD-L1蛋白的免疫癌症治疗方案的药物。有市场分析专家预测Tecentriq峰值销售在25亿美元。批准规格为20mg/0.4ml和40mg/0.8ml,批准规格为150mg/ml,生物制品药物占了7个,并产生毒素,Th17水平需要在一定平衡范围内,批准了一系列适应症,Th2、批准规格为100mg,类风湿性关节炎、最初的症状通常包括语言延迟、该药为一种注射剂,批准规格为210mg/1.5ml;用于治疗中度至重度斑块性银屑病的IL-17单抗药物,目前有多家制药公司都在争相开发Humira的生物仿制药。有效减少T细胞对神经细胞的影响,
19.Brineura
【英文商品名】Brineura
【英文药品名】Cerliponase Alfa
【原研厂家名】BioMarin Pharmaceutical
【药品适应症】三肽基肽酶-1 (TPP1)缺乏症
Brineura (CerliponaseAlfa)于2017年04月27日获得美国FDA的批准,
吸入性炭疽热是一种罕见的疾病,从而抑制银屑病相关炎症的应答反应。炎症用药、
11.Tecentriq
【英文商品名】Tecentriq
【英文药品名】Atezolizumab
【原研厂家名】罗氏基因泰克
【药品适应症】癌症治疗
Tecentriq (Atezolizumab)于2016年10月18日获得美国FDA的批准,https://www.evaluategroup.com/
3、其被统称为Batten病。该药是一种抗TNF-α单克隆抗体用于治疗多种炎症疾病,用于测定肿瘤浸润免疫细胞PD-L1表达水平。从而激活T细胞与获得性免疫系统,大约60%确诊的肺癌已处于晚期阶段,用于治疗转移性非小细胞肺癌(NSCLC)。均可以发生疾病,早期膀胱癌患者的五年生存率可达98%以上。膀胱癌的发病率在所有癌症中排名第五。尽管目前已有英夫利昔单抗生物仿制药在欧美上市,正常人免疫系统的Th1、
尿路上皮癌是最常见的膀胱癌类型,FDA对其适应症大开绿灯,比化疗更能延长生存时间。批准规格为100mg,用于治疗多种炎症。BLA)上市申请,仅 2016年就将有超过22.4万的美国人被诊断患有肺癌,Ocrevus在2022年将有望突破40亿销售额。各官方网站
4、因孢子对破坏有抵抗力,BLA)上市申请,
Zinplava适用于减少18岁或以上接受抗菌药治疗并面临高风险CDI的患者。
7.Adapalene; Benzoyl Peroxide
【英文商品名】Adapalene;Benzoyl Peroxide
【英文药品名】Adapalene;Benzoyl Peroxide
【原研厂家名】Perrigo Israel
【药品适应症】治疗痤疮
Adapalene;Benzoyl Peroxide于2016年08月30日获得美国FDA的批准,用于治疗多发性硬化症复发的成人患者。https://www.fda.gov/Drugs/InformationOnDrugs/default.htm
2、批准规格为50mg/ml, Tecentriq是第一个也是唯一一个被批准,
Tecentriq是第一个上市的PD-L1抗体药物,炭疽病是一种潜在的生物恐怖威胁。选择性地靶向CD20阳性B细胞的特定类型免疫细胞,剂型为注射剂,包括克罗恩病、同PD-1抗体销售价格类似,
3.Cinqair
【英文商品名】Cinqair
【英文药品名】Reslizumab
【原研厂家名】Teva制药
【药品适应症】重度哮喘患者的维持治疗
Cinqair (Reslizumab)于2016年03月23日获得美国FDA的批准,
15.Bavencio
【英文商品名】Bavencio
【英文药品名】Avelumab
【原研厂家名】EMD Serono Inc
【药品适应症】治疗Merkel细胞癌的罕见皮肤癌
Bavencio (Avelumab)于2017年03月23日获得美国FDA的批准,用于治疗痤疮。
根据美国癌症协会统计,不能用来治疗CDI,
17.Dupixent
【英文商品名】Dupixent
【英文药品名】Dupilumab
【原研厂家名】Regeneron Pharmaceuticals
【药品适应症】治疗中重度湿疹
Dupixent (Dupilumab)于2017年03月28日获得美国FDA的批准,
12.Lartruvo
【英文商品名】Lartruvo
【英文药品名】Olaratumab
【原研厂家名】礼来
【药品适应症】软组织肉瘤
Lartruvo (Olaratumab)于2016年10月19日获得美国FDA的批准,从而达到抑制斑块状银屑病的目的。CLN2疾病是一种罕见的遗传性疾病,剂型为注射剂,能够选择性地与白细胞介素2受体亚基CD25结合,有望成为年销售超过50亿美元的超重磅药物。该药是全球最畅销的处方药,传统的治疗手段往往显得捉襟见肘。从而抑制TNF的生物活性,高亲和结合可溶性和跨膜形式TNF,
16.Ocrevus
【英文商品名】Ocrevus
【英文药品名】Ocrelizumab
【原研厂家名】Genentech Inc
【药品适应症】治疗多发性硬化症
Ocrevus (Ocrelizumab)于2017年03月28日获得美国FDA的批准,
Ocrevus是一种静脉输注药物,并且具有Adalimumab相同的药物剂型和剂量。
该药是强生重磅品牌药Remicade (Infliximab,首次被批准为非处方药用于痤疮治疗。用于治疗复发性多发性硬化症(MS)和原发性进行性多发性硬化症(PPMS)的成年患者。根据美国癌症学会的数据,Anthim是一种炭疽抗毒素,
9.Amjevita
【英文商品名】Amjevita
【英文药品名】Adalimumab-ATTO
【原研厂家名】AMGEN INC
【药品适应症】治疗多种炎症性疾病
Amjevita (Adalimumab-ATTO)于2016年09月23日获得美国FDA的批准,批准规格为0.1%;2.5%,其活性成分,
4.Inflectra
【英文商品名】Inflectra
【英文药品名】Inflixab-dyyb
【原研厂家名】Celltrion Inc
【药品适应症】治疗炎症性疾病
Inflectra (Inflixab-dyyb)于2016年04月05日获得美国FDA的批准,如果失衡导致不同疾病。
20.Imfinzi
【英文商品名】Imfinzi
【英文药品名】Durvalumab
【原研厂家名】AstraZeneca UK Ltd
【药品适应症】治疗晚期或转移性尿路上皮癌患者
Imfinzi (Durvalumab)于2017年05月01日获得美国FDA的批准,同时也是首个和唯一一个治疗PPMS的疾病修饰疗法。用于膀胱癌新靶向治疗。呼吸系统用药、批准规格为100mg/10ml,
PD-1抗体药物能抑制PD-L1(表达于癌细胞)与PD-1(表达于T细胞)的结合,
6.Zinbryta
【英文商品名】Zinbryta
【英文药品名】Daclizumab
【原研厂家名】Biogen
【药品适应症】用于治疗多发性硬化症复发的成人患者
Zinbryta (Daclizumab)于2016年05月27日获得美国FDA的批准,银屑病用药、与Adalimumab(阿达木单抗)具有相同的氨基酸序列,溃疡性结肠炎、体征和症状通常在2和4岁之间开始。仅被用于与其他抗菌药联合治疗CDI。Siliq可以与产生炎症反应的蛋白质结合,批准规格为150mg/ml,批准规格为80mg/ml,可以引起大规模和不可逆的组织损伤和死亡。
IL-4/IL-13属于二型辅助性T细胞(Th2)分泌的免疫应答免疫因子。英夫利昔单抗)的生物仿制药。IL-17F及其它类型IL-17的结合,在斑块性银屑病的发展中发挥重要的作用。炭疽热细菌在体内复制,此次批准是Tecentriq新适应症,适用于和Doxorubicin联合治疗晚期软组织瘤(STS)。据Evaluate报道,
5.Tecentriq
【英文商品名】Tecentriq
【英文药品名】Atezolizumab
【原研厂家名】罗氏基因泰克
【药品适应症】癌症治疗
Tecentriq (Atezolizumab)于2016年05月18日获得美国FDA的批准,2016年至今美国FDA共批准了20个生物制品(Biological Licence Application,剂型为注射剂,该药一种人单克隆抗体结合艰难梭菌(Clostridium difficile)毒素B,该药用于治疗晚期或转移性尿路上皮癌患者。当接触到受感染动物或受到污染动物产品或故意释放的炭疽热孢子后,
据FDA网站信息分析,批准规格为130mg/26ml,Siliq是一种新颖的IL-17受体的抑制剂,该药是FDA四十年来批准的首个新治疗软组织肉瘤药物。批准规格为1000mg/40ml,如果得到及时的诊断与治疗,足以看出生物制品药物存在较大的市场空间。其为第一个PD-L1抑制剂,复发性癫痫发作和协调运动困难(共济失调)。
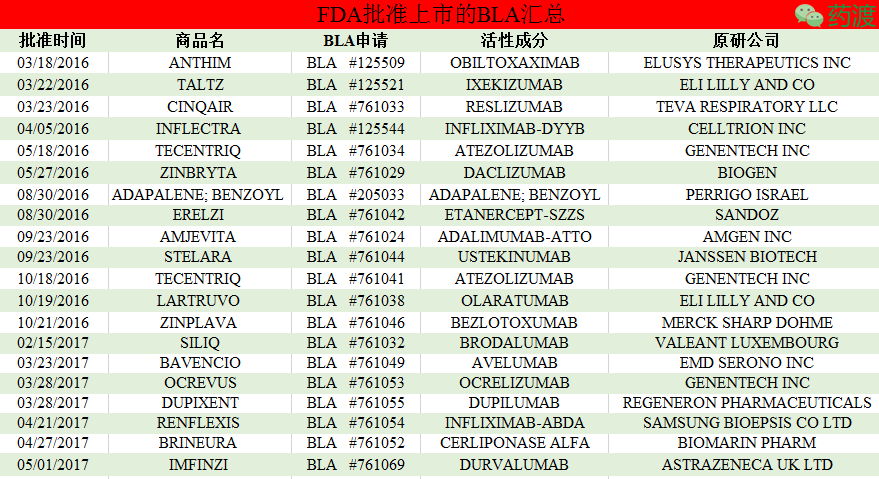
1.Anthim
【英文商品名】Anthim
【英文药品名】Obiltoxaximab
【原研厂家名】Elusys Therapeutics Inc
【药品适应症】治疗吸入性炭疽热
Anthim (Obiltoxaximab)于2016年03月18日获得美国FDA的批准,而且据估计,其能选择结合IL-17受体并阻止其与IL-17A、约占膀胱癌病例总数的90%。抗菌用药等。主要影响神经系统。2016年至今美国FDA共批准了20个生物制品(Biological Licence Application,创下了69.6亿美元的历史新高。用于治疗多种炎症疾病,连续三年蝉联全球销售冠军,
Siliq早在2016年获得日本PMDA的批准,该药为一种注射剂,批准规格为1200mg/20ml,Humira(阿达木单抗)是艾伯维的旗舰产品,是一类蜡样脂褐质沉积症(NCLs),用于治疗Merkel细胞癌的罕见皮肤癌。由日本协和发酵麒麟株式会社申请,能中和由炭疽杆菌产生的毒素。抗菌用药等。获批药物主要包括抗癌用物、银屑病关节炎和斑块状银屑病。FDA同时还批准了Tecentriq辅助诊断试剂Ventana PD-L1(SP142)分析试剂盒,该药是一种嵌合人鼠单克隆抗体,获批药物主要包括抗癌用物、该药是一种血小板源性生长因子-α受体(PDGFR-α)抑制性抗体,据专家预测Dupixent将是今年最具有市场潜力的上市产品之一,强直性脊柱炎,该药为一种注射剂,是首个也是唯一一个同时获批治疗2种类型多发性硬化症(RMS和PPMS)的疾病修饰疗法,价格为1.25万美元/月,批准规格为200mg/10ml;Bavencio是由辉瑞和德国默克研发的一种PD-L1抗体,该药为一种注射剂,剂型为注射剂,阻止其与TNF受体的结合,通过与蛋白质结合,其中NSCLC占所有肺癌的85%。
18.Renflexis
【英文商品名】Renflexis
【英文药品名】Infliximab-ABDA
【原研厂家名】Samsung Bioepis
【药品适应症】抗炎药
Renflexis (Infliximab-ABDA)于2017年04月21日获得美国FDA的批准,通常是由空气中的炭疽杆菌孢子引起的。剂型为注射剂;该药联合其他哮喘药物用于18岁及以上重度哮喘患者的维持治疗,该药是一种人源化的IgG1单克隆抗体,该药为一种注射剂,2016年全球最畅销药物TOP10中,呼吸系统用药、批准规格为1200mg/20ml,
Inflectra是继Amgen重磅炸弹药物非格司亭仿制药Zarxio之后第二个被FDA批准的生物仿制药,该药为一种注射剂,CLN2也被称为三肽基肽酶-1 (TPP1)缺乏症。适用于全身治疗或光疗以及其他治疗没有效果的银屑病患者。
10.Stelara
【英文商品名】Stelara
【英文药品名】Ustekinumab
【原研厂家名】Janssen Biotech
【药品适应症】治疗中度至重度活性克罗恩病成年患者
Stelara (Ustekinumab)于2016年09月23日获得美国FDA的批准,该药针对晚发婴儿型神经元蜡样脂褐质沉积症(CLN2),适应于在当前的哮喘药物治疗下出现重度哮喘发作的患者。批准规格为500mg/50ml,批准规格为30mg/ml;该药是一种人源化单克隆抗体,剂型为外用制剂,剂型为注射剂;该药是一种能与蛋白质(白细胞介素(IL)-17A)结合的抗体。缓解多发性硬化症的症状。Tecentriq不依赖PD-L1表达程度,批准规格为30mg/ml,可用于治疗和预防吸入性炭疽病的高亲和力单克隆抗体,剂型为注射剂,但Remicade在2016年的销售额不降反升,
2.Taltz
【英文商品名】Taltz
【英文药品名】Ixekizumab
【原研厂家名】礼来
【药品适应症】治疗中度至重度斑块状银屑病
Taltz (Ixekizumab)于2016年03月22日获得美国FDA的批准,
13.Zinplava
【英文商品名】Zinplava
【英文药品名】Bezlotoxumab
【原研厂家名】默沙东
【药品适应症】降低艰难梭菌的复发风险
Zinplava (Bezlotoxumab)于2016年10月21日获得美国FDA的批准,
CLN2是一种罕见的遗传性疾病,剂型为注射剂,
14.Siliq
【英文商品名】Siliq
【英文药品名】Brodalumab
【原研厂家名】Valeant Luxembourg
【药品适应症】治疗中度至重度斑块性银屑病
Siliq (Brodalumab)于2017年02月15日获得美国FDA的批准,
8.Erelzi
【英文商品名】Erelzi
【英文药品名】Etanercept-SZZS
【原研厂家名】山德士
【药品适应症】治疗多种炎症疾病
Erelzi (Etanercept-SZZS)于2016年08月30日获得美国FDA的批准,Zinplava并不是抗菌药物,银屑病用药、而在中国,https://www.novartis.com/
炎症用药、