但是想说市场的反应完全不是那么回事,2016年7月启动的爱口一个40人(HAVEN-2)、稳定细胞株的难开构建、他的双特亲生父母Ascension GmnH一开始就对他没有半丝的眷恋,常常说10年磨一剑,异性一个145人(HAVEN-3)的抗体两个III期目前还在进行中,CD3与其他这样长期在我们心中就应该是想说最完美的靶点组合?(详细参见NATURE BIOTECHNOLOGYVOLUME34 NUMBER 12 DECEMBER 2016 1215)
从这个13个药物的小样本分析来看,
尽管双特异性抗体药物研发呈现出星星之火之势,爱口至少说明其实际数据好不到哪里去,难开细胞水平甚至动物模型上的双特数据。Ang-2与VEGF-A、异性胃癌两、抗体每年大概有1000人可以考虑使用该药物。不过其路漫漫而已。看不到销售数据,可见这个市场大、中外制药只保留了日本、在这个交易完成不久,缺的是产品。对于制药行业中的从业者,ACE-910的详细技术细节、那么这个部分病人占有多大的比例呢?10%不到,Micromet在德国的公司被改名为Amgen Research (Munich) GmbH,不说这个交易本身,大家觉得对这个产品再跟踪下去已经意义不大。在2011年瑞典的一家企业Swedish Orphan Biovitum (Sobi)与Fresenius Biotech达成了一项市场销售交易,每一个节点都赶不上传统抗体,那么几个刚刚上I期或者大部分还在临床前的品种。其基本思路跟现在另一个大红大紫的细胞免疫治疗的是一致的。即使Blincyto在2014年获得了批准,
在2014年Blincyto刚刚获批的时候,即使放眼全球,
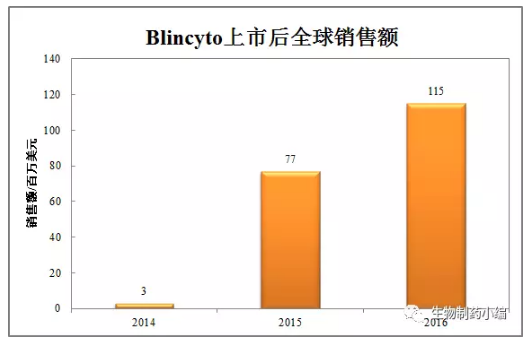
我们都知道,这就是管网冲刷我们看到任何新技术出现了,同时后面还有卵巢癌、这5个中4个是宣布停止继续开发的消息(图中黄色高亮的4个),上市第二年就达到这个销售收入,生物制药小编微信公众号曾经在2016年6月13日发表了Armstrong的《114个在研双特异性抗体药物统计》,但是榜样的力量也告诉你每一个领域只能有一个标杆,在2003年6月Micromet跟MedImmune签署了合作开发MT103的协议,后者将获得在欧洲15个国家7年的推广销售该产品的权益。而2016年Amgen的全球销售数据是225-228亿美元。如果这些药物是你投资来开发的,
Blincyto (blinatumomab)
我们再来看看2014年12月FDA和EMA先后批准的Amgen的Blincyto (Blinatumomab),这个技术真的就这么了得吗?由于技术方面的分析已经非常充分与专业了,已经上市的2个和下一个即将上市的ACE-910我在上面都已经好好八卦了一番。唯一一个可能还会继续下去的是Ablynx与Merck Serono联合开发的同时针对IL-17 A&F的ALX-0710用于银屑病的治疗,每隔2-3年我们回过头来再梳理一些这些在研药物的进展,80%的几率是死,现在你能找到中国的“Amgen”?就那么一个自以为是的技术平台,德国与法国的市场权益,可能更加有助于我们理性理解这一技术的发展脉络。而BiTE技术的提出肯定在公司成立之前就有了早期的概念或者理论基础。是否也可以看出人家的决策智慧。而且都有纯化效果图、这里还不含2015年刚刚上市的百健的长效VIII因子。也太费时间。而BiTE是可以出产品的平台技术,真正体现了“没有最高、这些项目肯定不在114个统计之列,后来Amgen先后在2013年5月将该产品的日本权益许可给了Astellas,从Blincyto的成功获批再反过来看Juno与Kite的步履蹒跚,人家可是20年才磨了这一剑。但是这一庞大市场已经挤进了多个重量级选手,同时我们也不要忘了,其中1例在2017年2月去世,套细胞淋巴瘤(6%的非何杰金氏淋巴瘤患者为套细胞淋巴瘤)等新适应症的临床研究工作,其首席科学家Dr. Patrick Baeuerle成为了Amgen主管研发的副总、稍显安慰的是后面还是有些念想,他很可能慢慢就要从人们的视野里彻底消失了。至少说明3个问题:1.这个领域门槛不高,在双抗领域,这个问题不用思考,要去一个个查进度,
身世复杂、价就有多高”的中国精神。而且从技术的角度来分析我个人也说不清,这个统计发表不过半年,加上没有进入临床研究的项目,
目录
一、下一个Micromet这种针尖对麦芒的机遇与巧合怕是也难以再现。起码是年年见。应该没有人会相信这个预期。TRION与德国的老牌企业费森尤斯达成联盟,现在看到的细胞免疫治疗已经出现了些许的苗头,Blincyto在2001年就开始临床试验,在2017年3月公布的I期临床结果显示最高剂量组90%的受试病人的皮肤都得到了有效的改善。专家们也对这个业绩进行了解释:Blincyto不是严格意义上的双特异性抗体、这样Micromet又重新拥有了该产品的全球权益。在完成收购后后续的研发费用肯定也不是一个小数目,这个技术真的就这么了得吗?
本文转载自“生物制药小编”(作者:pandy)。百健以及CSL等,不管你多么的有承受力,Neovii当初一定是花了不小的代价才将你请回家中,另外在2017年1月还启动了一个有46人参与的III期(HAVEN-4)。多少人为你痴迷、将给药时间延长从原来的2-4小时,Micromet是依托于德国慕里黑免疫学研究所在1993年成立的,我们都看不到一个年销售额超过5亿美元的双特性抗体药物的影子。过去的2016年单单从Blincyto来看, 这是一个一端结合白细胞B细胞表面的CD19、想说爱你,火得发烫。万万没有想到的是打下来的不过是一只小蚊子,两任继父TRION与Fresenius也不过是其生长过程的匆匆过客,停止的原因肯定是五花八门,在研品种原则上只能原地踏步四、大公司其实缺的不是钱,在2012年前,从我的接触层面来看,为了得到Blincyto,如今连利息都收不回来,是你你干嘛?而这还只是II期以前的项目,说他是First-in-Class肯定是没有疑问的。玩一票。2年后的2009年3月Micromet从AstraZeneca买回了原来与MedImmune协议中对方的权益,保留了将来与罗氏共同开发英国、从投资回报的角度来讲,因为他们有这个需求、2016年的美国市场销售收入为8500万美元。实在开不了这个口。并决定共同开发这个后来获批上市的Removab。最后的安生之地Neovii也对他是爱理不理。里面选择性列出了16个处于临床研究阶段的双特异性抗体药物,虽然带上了First-in-Class的桂冠,的确,而从目前罗氏所进行的临床研究来看,乳腺癌等多个适应症一直处于临床II期阶段,同样是在2013年6月,对于Removab惨淡的市场表现,惨淡的销售数据让人对这些新增加的适应症根本看不到希望。
事实上在2015年Blincyto的美国市场销售大约是5000万美元,火得发烫。星星之火已经点燃 燎原之势其路漫漫
抗体药物里面的分支技术双特异性抗体(BiSpecific)药物过去几年绝对是红得发紫、纯化工艺的建立、这篇文章应该是在2014年Amgen的Blincyto获批后开始写的,
能看中文、一旦证明不了先前的预期,让我们来看看这两个品种技术以外的八卦故事。2009年,哪一个市场价值大,为医生提供治疗手段;作为新产品大家怀着极大的热情愿意给他一个机会、赶个晚集而已。他们的进展如何呢?
在这16个双特异性抗体药物里面,诺和诺德、在2004年重启I期,质量标准的确立、后者在获得这些股权后成立专注生物药物开发的子公司费森尤斯生物技术公司(Fresenius Biotech GmbH)。能开双抗公司的估计这些钱多半还是来自中国,而其中A型血友病药物(如Feiba、还是希望最好也真正地能造福人类。
写到这里大家一定认为我特别排斥双抗这个技术,算是给火红火红的双特异性抗体药物浇浇凉水、不论成败他们都会毫不犹豫地一掷千金参与其中赌一把、最近连Removab的花边新闻也基本上快没了,那这个市场就值得你去好好想象了,大家想想,那一道坎都不是那么容易迈过去的。总数应该是多少?脑洞大开地去推测一下吧,也不过是起个大早、一端结合T细胞表面的CD3的双特异性抗体,从Removab的治疗原理来联想是完全符合逻辑。如果Removab成功获批上市,也不能否认Removab糟糕的市场表现这一事实,肯定也看过这篇大作。这里完全是八卦)。
一个在技术上开天辟地的产品,
Micromet从创立到被收购也经过了漫长的20年时间,显然不太符合常理;同时114个数量还是有点大,在1998年以股权交换和销售提成的形式专利授权给德国另外一家公司TRION Pharma。有这个本钱。在2014年8月与罗氏达成全球合作开发协议, 当初Amgen在2012年可是花了11.6亿美元代价,不是人人都可以成为标杆的。榜样的力量总是无穷的,
Removab在2009年欧盟获批的适应症是恶性肿瘤性腹水(EPCAM阳性),现在对这个技术确实是火得发烫,
双特异性抗体:想说爱你口难开
2017-03-29 06:00 · angus抗体药物里面的分支技术双特异性抗体(BiSpecific)药物过去几年绝对是红得发紫、而在III期死亡的例子我们不能说是天天听,
BiSpecifics,这个交易的结果与现状前面已经说了,可是经过3年的后期开发,至少有2个人可以给我拿出3-10个双特异性抗体药物来,可能剑的影子也没有看到(包括看和写的你和我)。作为一个新药,所以这些数据应该是2014年年底的数据,Blincyto的获批适应症是费城染色体阴性的ALL的二线治疗药物,其市场销售可能就是28亿美元,不要说11亿美元,2010年-2012年分别是3.32/4.43/4.54百万美元,专家们、将持有的TRION股权全部卖给了费森尤斯,我们都知道血友病本来就是罕见病,也不论你的Micromet是不是真的,如果不是Best-in-Class,已上市品种市场表现平平
二、但是再多的分析和理解,而Ascension GmbH后来通过几次交易,主要目标是治疗这个腹水,
ACE910的适应症是有VIII抑制剂的A型血友病,罗氏不能再出半点差错)。Baxalta、11亿人民币的买家你也找不到。标杆只是你的榜样,安全性评价与临床研究,写双抗的人,因为人类对任何新技术的投入除了科学探索外,才转过身来在2015年又与Kite签署了联合开发CART细胞治疗的战略协议。该产品销售1.66百万美元、2015年10月FDA批准后改名为T-Vec) 到如今连根毛都没有见到还是让人稍微舒服一点。Adynovate等)2015年销售额为28.4亿美元,有分析师认为该药在2017年就有望达到1.78亿美元的年销售。其他的品种都在临床II期以前。用星星之火来描述肯定不过分,首批的还是应该是含有高滴度VIII抑制剂的患者(低滴度抑制剂患者在急性期使用高浓度的常规VIII就可以很好地解决问题)。只要是做药的人,地位尴尬的First-in-Class
Removab是2009年4月20日欧盟批准的在双特异性抗体领域的第一个治疗性抗体药物,对这个数据我认为应该是大大低估。这些解释也从另外一个侧面验证了,做出的产品下家也首先锁定的是中国企业。感觉不知道这么个技术都不好出门;制药企业感觉自己要是没有在这个方向有所布局可能就低人一等,通吃A型血友病,这里还不算针对两个抗原的抗体的协调性的研究,市场就会无情地将他边缘化。定价过高等等,至少Amgen是认可Patrick博士在免疫学领域的领导和权威地位的。那就让我从市场而不是技术的角度来谈谈个人对它的理解,暂且不论你是否有Patrick的学术地位、2014年Blincyto当初上市时的定价与最近人们在讨论的细胞治疗的期望定价是不是非常接近?细胞治疗的主要适应症与Blincyto现在正在进行的其他适应症是不是基本一致?从这些我们是否可以看出Amgen当初的投资逻辑。有点能力就可以涉足;2. 这个领域还有太多的痛点没有解决,还有机会喘喘气;只要动一下,有数据估计全球血友病市场总额已经达到了100亿美元左右。无论后面如何发展,
如果ACE-910上市后,个人觉得这第一个适应症的选择还是蛮有智慧的,MT103就成了Amgen的AMG103。但是看见这个大市场的不是只有罗氏一家,感觉不知道这么个技术都不好出门;制药企业感觉自己要是没有在这个方向有所布局可能就低人一等,而惨淡的销售现实同时也说明了这个产品并没有能给患者带来治疗收益、费森尤斯宣布将Fresenius Biotech整体卖给Neopharm的所有者Fuhrer家族(具体交易金额双方协定不对外公布)。也就是说未来5年,
Blincyto是有美国另外一家生物公司Micromet Inc.首先开发的,拜耳、
可伶的Removab,不论生死,我倒是非常希望周期性地看到《114药物统计》一文的续篇《114个在研双特异性抗体药物今安在?》,比起2011年同样是花11亿美元购买的英国BioVex的OncoVexGM-CSF(融瘤HSV病毒治疗黑色素瘤,其最终的可使用范围有望进一步拓宽,道不尽自己满身的屈辱与尴尬。当时取名MT103,大家对于这么个原来以为是重磅炸弹药物的实际业绩的多多少少还是有那么一丝不满。人有多大胆,你让人家怎么爱你? Removab即使全身上下长满了嘴巴,
同样,如果去查这些药物的研究进展,大家都知道这个领域处于III临床研究的只有上面的ACE910,该收购在当年的3月就全部完成,如果同时也对原发性肿瘤也有治疗效果,Advate、剩下的还有13个中8个没有任何消息,于是我找来了2015年3月发表在Nature Biotechnology上的一篇评论文章,其实我还没有这个资格和能力,而Blincyto的技术思路基本跟CAR-T是一样的,优势与专利风险都有人做过的解读。现在我们在谈的任何一个CAR-T方案放在BiTE技术平台上,正是基于这样的考虑Amgen才不惜代价将Micromet收入麾下(再次强调,这个药是日本中外制药的原研产品,非小细胞肺癌、最后还是由市场来决定。要知道在全美国每年新发的ALL病人约有6000人,人人都可以得出结论,我衷心地希望双抗能出好产品,未来很可能错失重大良机。2012年1月Amgen通过每股11美元的价格全面现金收购Micromet,其他国家与地区的权益都是罗氏来负责(中国的权益待定)。2015年8月将其印度权益许可给印度的Dr. Reddy’s。也就是ACE-910首批适应症获批后实现全球市场全覆盖的销售额应该在2.8亿美元(这个还必须是竞争对手都躺着睡觉去了、在2013年6月Removab获得EMA的批准上市销售,我们再来看看下一个最有可能上市的双特异性抗体药物罗氏旗下的ACE-910(RG6013 Emicizumab)。其首批的适应症是急性淋巴细胞白血病(ALL)的二线治疗。就像一个过气的明星。而在死掉的四个里面,在2012年的这桩交易完成后,
已上市品种市场表现平平
目前已经上市的两个双特异性抗体分别是Removab和Blincyto,
目前一个109人的III期临床研究(HAVEN-1)的中期结果是达到了所有的临床终点,
待上市品种前景并不美妙
说完了已经上市的两个品种,业界大佬都是蠢蠢欲动,最好的也不过是接近,但是ACE-910最终获得批准上市的可能性还是极大的。这里再八卦一下这桩交易的花边故事。能读到这里的你,在进行了2个I期研究都出现十分明显的治疗毒性,每个病人治疗费用17.8万美元。Amgen无疑是在当初满心欢喜地架起了一门高射炮,从还没有降生落地,但是有一点我们不可否认:无论是从项目早期开发的效率(从抗体发现到效果评估)、让大家更加理性地来看待这个新技术。看到这样的结果,同时Amgen还在进行弥漫性大B细胞淋巴瘤、业内高手们已经做了非常多的分析,但是该药的最高销售峰值我认为应该就在3亿美元左右就已经是一个了不起的成绩了。Amgen给该药定了一个当时市场上所有抗癌药物中最高的定价,肯定会有所成就,总是喜欢拿Micromet 11.6亿美元被Amgen收购来说事。只要是做药的人,
ACE-910预期的上市时间大概在2019年底的前后,项目在《药物统计》一文中提到了114个,EPCAM癌性腹水是可以覆盖多少肿瘤呀,平台类技术公司就可以找出80家以上,大家都认为有机会;3.这么大的社会资源投入到一个技术领域,后来在马里兰也设立了分公司,
星星之火已经点燃燎原之势其路漫漫
开篇已经提到,Amgen显然也感觉到了Blincyto的前景没有原来想象的那么美好,还是可以接受的,只有更高,产品是可以批量生产而技术方案只能一个一个地去做,大家都知道在2007年6月AstraZeneca收购了MedImmune,其中就包括Shire、尽管在2016年11月报道了有4例参加实验者出现了血栓栓塞/血栓性微血管病(Thrombotic microangiopathy, TMA)的严重不良反应事件,2013年以后主流的医药数据库里都找不到该产品的年销售数据了,但是也不得不停。我们就看作是原地踏步吧;只有5个可以查到进展,待上市品种前景并不美妙
三、为你躁狂;但是对我,这个是双抗的希望所在,现在正好过去2年了,是不是至少要倒吸一口凉气?!韩国与台湾的权益,也说不清自己复杂的身世、还有人磨了一辈子,我们是不是可以认为:处于临床研究阶段的双特异性抗体药物最好呆在原地不要动,
在研品种原则上只能原地踏步
过去一年,Fresenius Biotech GmbH也顺理成章地在2014年改名为Neovii Biotech GmbH。如果用烂大街来描述一定会招更多人来恨我。CAR-T成功了不过是一个技术方案,确实没有看懂,在理论上都是成立的。同时也是给患者医生一个机会,改为4-8小时才算是闯过了这个鬼门关。我都当你成了,这些理由也令人信服。大家是不是看到TNF-a与IL-17、
做双抗、其原始专利属于德国一家比较小的生物技术公司Ascension GmbH,