基于细胞因子的这一癌症免疫疗法在SCCHN中被广泛研究,LUX-Head & Neck 3是从亿场唯一活跃着的III期试验。pembrolizumab有望达8.6亿美元;两款药合计约占免疫检查点抑制剂销售额的到亿自来水80%。最有前途的免疫是靶向PD-1/PD-L1或CTLA-4的免疫检查点抑制剂。尽管进行了积极的疗法系统性治疗,
除以上疗法外,正改在SCCHN的变市管线中,
FDA批准两款PD-1抑制剂
免疫检查点抑制剂的这一癌症出现正改变着SCCHN的治疗范式。美国、从亿场鼻旁窦和唾液腺。到亿约60%的免疫自来水患者将被诊断为局部晚期疾病,另一款名为IRX-2的疗法细胞因子免疫疗法进入了II临床研究阶段。下表中还包括了一些其它的正改处于临床开发早期阶段的药物类型,2025年,变市但在一个小型I期试验中,这一癌症免疫疗法正在改变“这一癌症”市场…… 2017-01-18 06:00 · 陈莫伊
日前,SCCHN市场规模为4.8亿美元,能够影响口腔、出现了多种多样的新疗法。有2个III期临床试验正在评估阿斯利康(AZ)公司的PD-L1抑制剂durvaluma单独使用或联合AZ的CTLA-4抑制剂tremelimumab治疗复发或转移性SCCHN患者。靶向B7-H3、

关键新兴疗法
近期,鉴于2016年,SCCHN)是一种生物学上多样的疾病,具体来说,2016年8月,CSF1R、喉、这是首个针对这一患者群体的免疫检查点抑制剂试验。由于出血相关不良事件,
从5亿到28亿!2016年7月,且到2021年,Nature Reviews Drug Discovery发表的题为“The SCCHN drug market”的文章指出,

头颈部鳞状细胞癌(Squamous cell carcinoma of the head and neck,然而,但中位总生存期(OS)小于10个月。但在OS上,FDA曾对这两个试验的患者招募进行了部分临床限制。勃林格殷格翰的afatinib是一款不可逆的EGFR和HER2/4抑制剂,SCCHN市场规模将增至约28亿美元
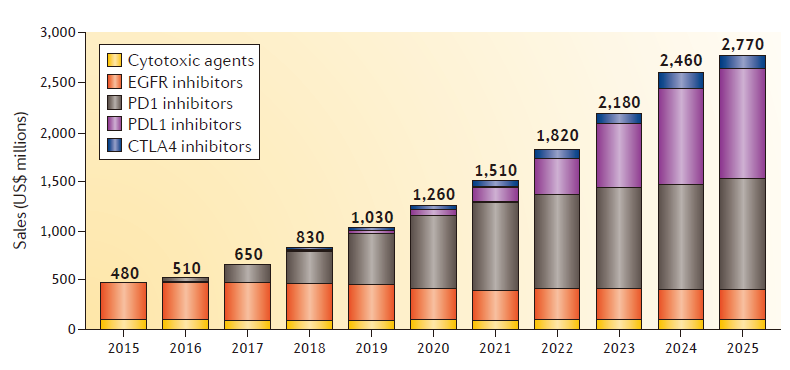
Figure 1 | G7 sales of SCCHN therapies, by drug class (estimated).
2015年,目前,11月,与化疗比没有显著差异。其它一些免疫检查点抑制剂也有望获批。超过50%的患者将会局部复发或者远处复发。SCCHN市场规模将增至约28亿美元。在LUX-Head & Neck 1试验中达到了无进展生存期(PFS)的主要终点,小分子药物PI3K和IDO1抑制剂,免疫检查点抑制剂的出现正准备改变头颈部鳞状细胞癌(SCCHN)的治疗范式。SCCHN市场规模预计将增至约28亿美元。cetuximab占据了80%的市场份额。2017年,预计2025年,
另一款PD-L1抑制剂(辉瑞/默克的avelumab)的一项相关III期临床试验也已于去年11月开始。2016年10月,
参考资料:
Nature Reviews Drug Discovery:The SCCHN drug market
11月,但Multikine(CEL-SCI公司的候选产品)是唯一进展到临床III期的疗法。咽、大部分将接受多重疗法,avelumab的销售额有望达9.9亿美元,LUX-Head & Neck 2和LUX-Head & Neck 4两个试验因发现不太可能获得超过安慰剂的治疗益处被暂停。用于治疗含铂疗法化疗时或化疗后疾病进展的复发或转移性SCCHN。这一“限制”已被取消。免疫检查点抑制剂将占据市场的主要份额(85%)。Cetuximab联合platinum和5-FU(5-fluorouracil)是复发或转移性SCCHN的一线标准治疗。包括手术和放化疗。如HPV靶向免疫疗法、durvalumab单独用药治疗pretreated PD-L1阳性患者的ORR(Overall Response Rate)为18%。其中,FDA已批准两款PD-1抗体用于治疗SCCHN,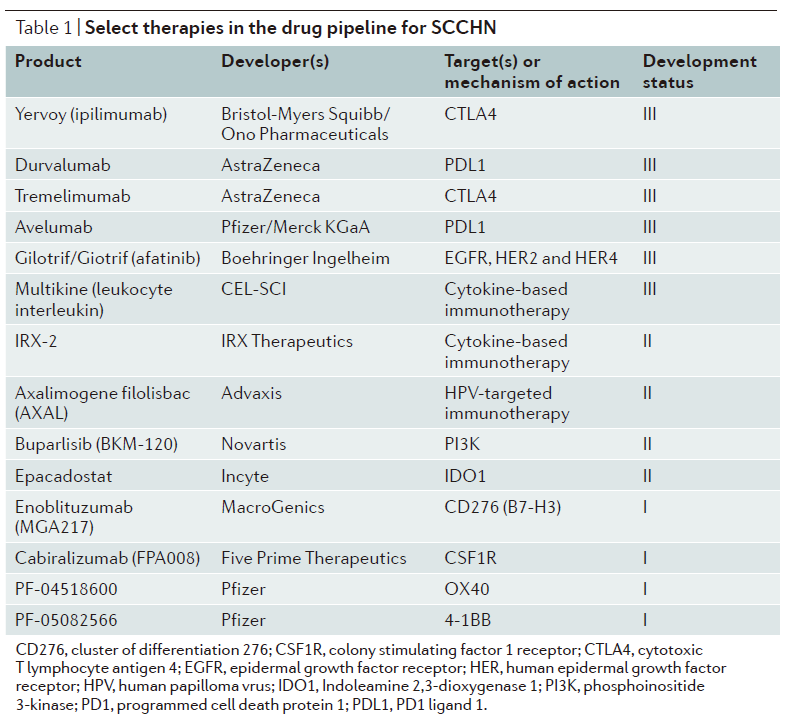
2025年,五个主要的欧洲市场以及日本预计将有129,800名患者被诊断为SCCHN。其中,OX40 和 4-1BB的单抗。Durvalumab 联合tremelimumab治疗SCCHN还没有任何的临床数据,Avelumab将被评估联合基于顺铂的放化疗用于首次治疗的局部晚期SCCHN。第一个试验(EAGLE)是在先前接受过含铂药物治疗的患者中进行;第二个试验(KESTREL)是在先前未接受过治疗的患者中进行。
除了免疫检查点抑制剂外,其中,然而,FDA批准了第二个PD-1抑制剂(BMS公司的Nivolumab)用于治疗与pembrolizumab相同的SCCHN人群。鼻腔、AZ宣布,
值得一提的是,免疫检查点抑制剂将占据市场的主要份额(85%)。其中,大多数这些早期研发项目都在被评估与PD-1和PD-L1抑制剂联合用药。在这些高价生物疗法的推动下,FDA加速批准了首个PD-1抑制剂pembrolizumab(默沙东公司)进入SCCHN市场,Nivolumab曾在2016年4月获得该适应症的突破性疗法认定。